吊瓜學名栝樓(TrichosantheskirilowiiMaxim),葫蘆科多年生藤本植物,又名瓜蔞。其塊根肥厚,根與果實均可入藥,具有止瀉、抗菌、消炎、降低膽固醇、調節免疫力、抗衰老與抗癌的作用。吊瓜籽富含植物脂肪和微量元素,是食用瓜子中的佳品。因此吊瓜是經濟價值較高的藥食兩用植物...
上一個:空氣鳳梨組培快繁技術優化
下一個:金線蓮組培快繁技術研究
吊瓜學名栝樓(Trichosanthes kirilowii Maxim),葫蘆科多年生藤本植物,又名瓜蔞。其塊根肥厚,根與果實均可入藥,具有止瀉、抗菌、消炎、降低膽固醇、調節免疫力、抗衰老與抗癌的作用。吊瓜籽富含植物脂肪和微量元素,是食用瓜子中的佳品。因此吊瓜是經濟價值較高的藥食兩用植物。
吊瓜喜光耐陰,不耐寒與旱,怕澇,適宜在深厚、疏松、濕潤的土壤中生長。利用種子播種方式進行繁殖時,后代分離嚴重、一致性差、病毒病發病率高、選育周期長;而采用塊根營養繁殖方式易受多種蟲害與病害的侵襲,其中以病毒侵害為嚴重,感病率可達100%,致使果實產量與品質退化,兩種方式都直接影響瓜農經濟效益。為保證吊瓜的優良品性,人們利用莖尖脫毒組培技術生產吊瓜脫毒苗,但因其操作難度大,出苗率低且周期長,極大地限制了脫毒苗的數量。因此,本試驗利用離體莖段的腋芽來誘導組培苗,以期建立吊瓜組培苗快繁技術體系并為實現吊瓜脫毒苗的批量生產提供技術支持。
1 材料與方法
1.1 試驗材料
供試吊瓜品種為“越蔞2號”。移栽所用基質由珍珠巖、蛭石、草炭土(體積比1∶1∶1)調配,1 000倍多菌靈溶液消毒。
1.2 試驗方法
1.2.1 離體莖段腋芽的消毒方法 選取生長10 d以內的吊瓜幼嫩藤狀莖頂部,除去藤狀莖上的葉片與卷須,將主莖剪成一葉莖段(上短下長),流水沖洗20~30 min。于超凈工作臺內,用潔凈的干紗布吸去莖段表面的水分,75%酒精浸泡15 s后取出,用蒸餾水沖洗2~3遍,再用0.1%的HgCl2溶液浸泡8~10 min,其間不斷搖動,棄去HgCl2溶液用無菌蒸餾水沖洗4~5遍。將莖段表面水分晾干后剪去莖段兩端少許備用。
1.2.2 不同培養基配制 試驗所用不同培養基設計見表1。
1.2.3 離體莖段誘導與莖蔓生根 將消毒后的離體莖段按照生物學極性方向接種到不同初代培養基配方下,每配方為1個處理,每處理接種6瓶,每瓶接種5~8個莖段。后置于25℃左右、光照12 h/d、黑暗12 h/d的環境下進行培養。1周后觀察不同初代培養基處理的莖段腋芽誘導情況并計算誘導率。
待初代培養基中腋芽長至4~5節帶葉莖蔓后,將帶葉莖蔓剪成一葉莖段,去掉葉子后接種到繼代培養基中,每瓶接種5~8個莖蔓。觀察不同繼代培養基配方處理的莖蔓生長情況。
表1 不同初代、繼代、生根培養基的配方設計
注:MS培養基中蔗糖濃度為30 g/L,瓊脂用量為7.5~8.5 g/L, pH值為5.8~6.0;“—”表示無激素添加。
待繼代培養苗長至6~8節后,將莖段剪下接種到生根培養基中,每瓶接種2~4個,誘導生根。觀察不同生根培養基配方處理莖段的生根情況并測量根直徑、平均側根數目。
1.2.4 組培苗煉苗與移栽 生根后將組培苗取出,沖洗干凈瓊脂后移栽到裝盆的消毒基質中,淋透1 000倍多菌靈溶液,室溫培養,濕度保持在90%以上。1周后濕度降低到70%~80%,噴1次1 000倍多菌靈。待濕度降低到50%~70%,試管苗長出新白根和葉片蠟質層后將苗移栽到大田。
1.3 數據處理
采用Microsoft Excel 2003 進行數據處理。
2 結果與分析
2.1 不同初代培養基處理對莖段腋芽誘導的影響
將消毒的一葉莖段移入初代培養基,莖段污染率低(3%以下)。3 d后腋芽全部開始伸長并長出葉片,莖段下部膨大(圖1 A);8 d后主莖伸長,葉片變大,卷須出現,莖段下部膨大部位變粗變白(圖1 B);14 d后主莖長至4~6節帶葉莖蔓(圖1 C),此時的莖蔓可用繼代培養。

圖1 初代培養基1處理的莖段腋芽經誘導形成莖蔓
不同初代培養基處理下的莖段腋芽誘導率不同。IAA濃度為0.2 mg/L的初代培養基處理下,莖段腋芽誘導率均高于0.5 mg/L IAA濃度處理;初代培養基2處理下的腋芽誘導率高(99%),生長速度快;初代培養基4處理下腋芽誘導率低(67%),生長速度慢(圖2)。
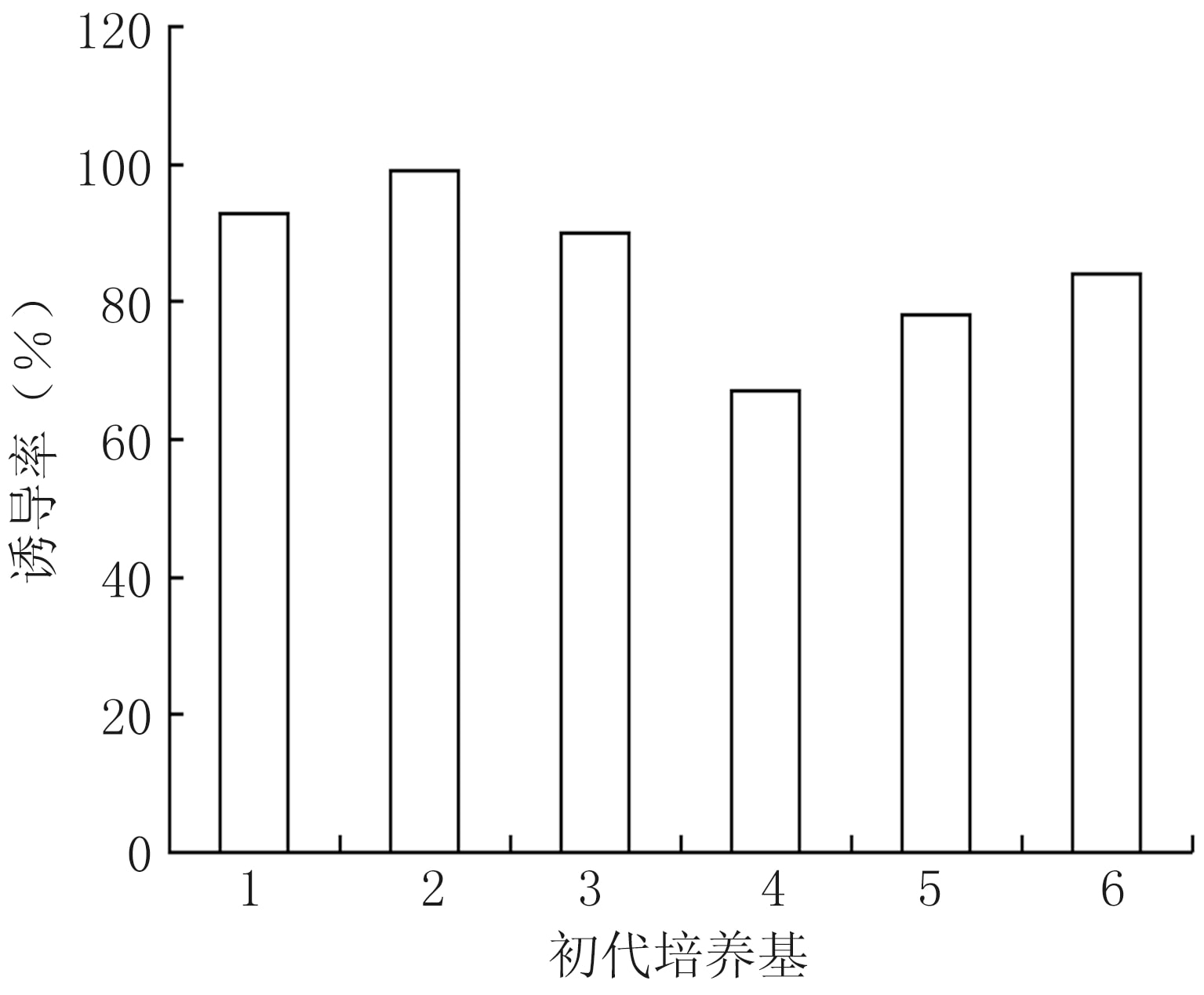
圖2 不同初代培養基莖段腋芽誘導率
2.2 不同繼代培養基處理對莖蔓生長的影響
將初代一葉莖蔓或多葉莖蔓轉入不同繼代培養基中,發現莖蔓長勢緩慢甚至停滯,即使誘導出新的帶葉莖蔓,莖節短,葉片呈現黃色、直徑小。莖段下部膨大部位變粗變白趨勢與初代培養莖段相比明顯減小,部分莖蔓變黃枯萎。故不同繼代培養基下的繼代培養苗均無法獲得。
2.3 不同生根培養基處理對莖蔓生長的影響
因初代培養的莖段在繼代培養基下無法獲得繼代莖蔓,本試驗將4~6節帶葉莖蔓的初代培養苗直接轉入生根培養基(圖3 A)。不同生根培養基處理下生根前莖蔓均生長緩慢,后下端顏色逐漸變深,1周后開始長出3~5條短根(圖3 B);3周后主根上生長出側根,莖蔓生長變快(圖3 C);4周后組培苗變為深綠色,根部發達,長勢強勁(圖3 D)。生根培養基1—6處理下的莖段生根率分別為81%、85%、88%、88%、87%、89%。

圖3 不同生根培養基處理莖蔓生長狀況
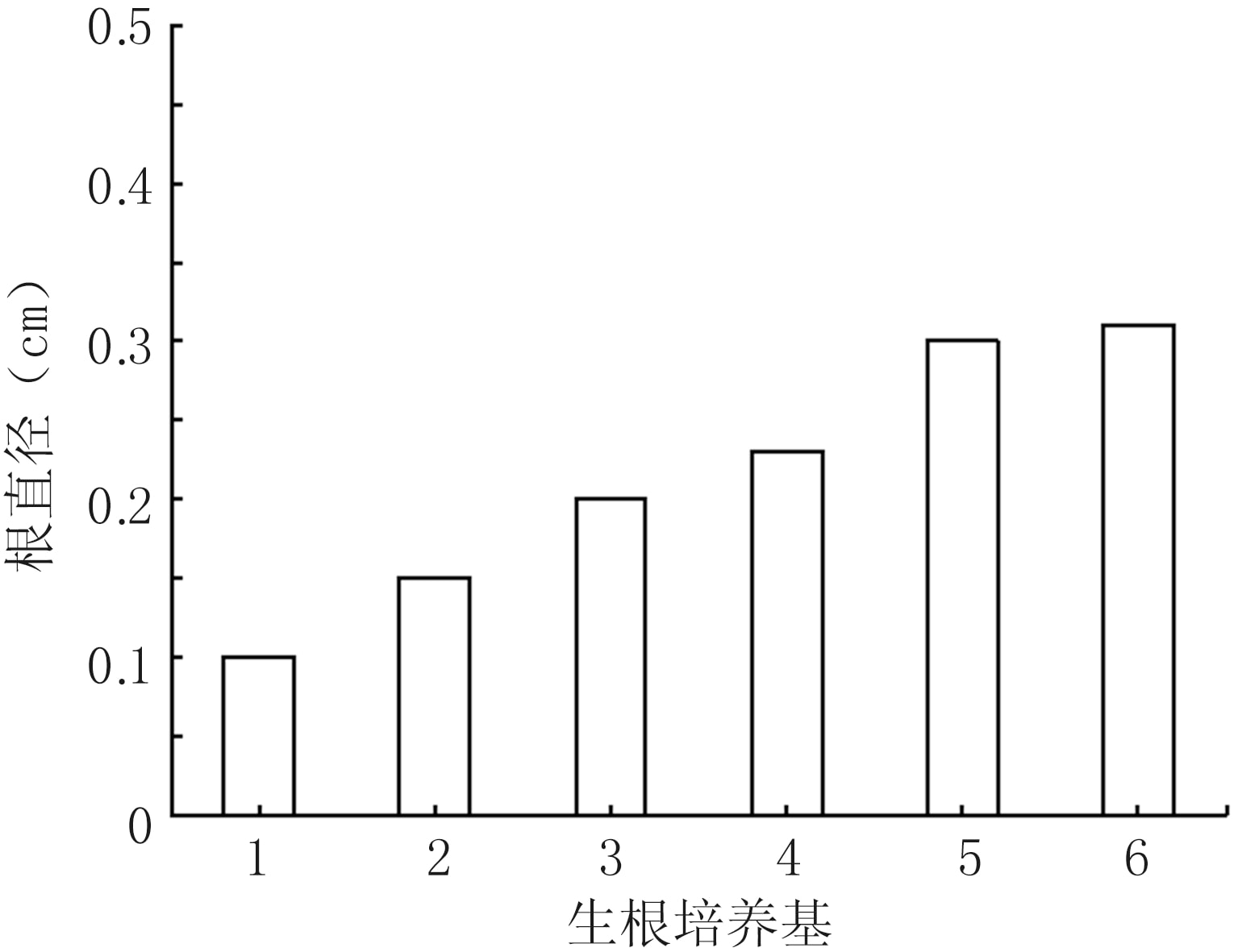
不同生根培養基處理對根的影響不同。莖蔓下端誘導生根第22 d時,隨著不同生根培養基處理中IBA濃度的增加,根的直徑變大(生根培養基1—6處理下分別為0.10、0.15、0.20、0.23、0.30、0.31 cm),平均側根數減少(生根培養基1—6處理下分別為4、5、8、2、1、0個)。其中生根培養基3(IBA濃度為0.5 mg/L)處理的根長勢快、直徑適中,側根數目多,且幼苗長勢相較于其他培養基植株快(圖4)。
2.4 煉苗與移栽方式對組培苗成活率的影響
煉苗可以使植株定植后迅速適應大田環境,縮短緩苗時間,增強對不良環境的抵抗能力。這對組培苗尤為重要,組培苗在培養期間環境濕度大,如果直接將其移栽至大田中植株會因失水而迅速死亡。
將生根組培苗從組培瓶中小心取出,洗去培養基,移栽至滅菌的基質中進行煉苗,無菌苗易感染雜菌,因此移栽后淋透1 000倍多菌靈溶液有助于幼苗生長。此時幼苗密度可適量增加(每平方米100株)。
待吊瓜苗1個月后長至8~13節,主莖2~3 mm,葉片直徑5~9 cm,新根增加,葉片形成蠟質層(圖5 A)時,將其小心移栽至單盆中,也可以直接將幼苗移栽至大田中,移栽過程中避免損傷根部(圖5 B)。經過煉苗移栽后幼苗成活率可達90%以上。
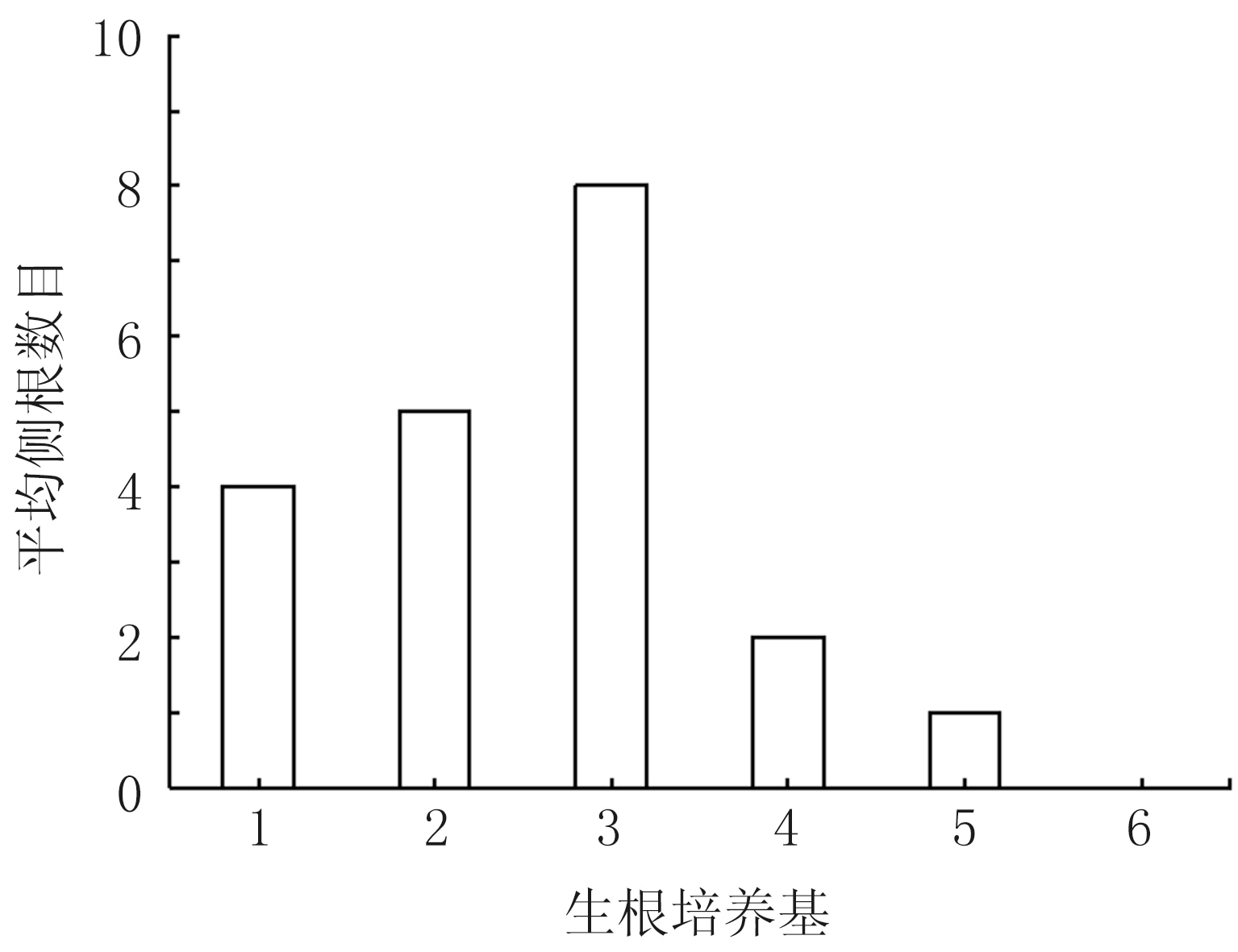
圖4 不同生根培養基處理對根的影響


圖5 組培苗煉苗與移栽時的生長狀
3 討論與結論
本試驗結果表明,利用“越蔞2號”吊瓜初代離體莖段經不同初代培養基誘導可獲得莖蔓,其中6-BA與IAA濃度為0.5 mg/L和0.2 mg/L組合時,誘導率高,為99%,此時莖蔓性狀良好、長勢旺盛。初代培養的莖蔓轉入繼代培養基后誘導率低,生長緩慢甚至死亡。植物激素與營養物質是植物生長所必需的,初代培養苗主莖纖細,本身營養物質少,對培養基中的營養物質吸收率低,只能依賴激素刺激生長,而繼代培養后其本身的生命活力受限不能獲得誘導苗。因此我們直接用初代培養獲得的莖蔓進行誘導生根。
植物生長調節劑IBA通常用來促進組織生根,但過量使用非但不利于側根的形成而且易造成根部變粗畸化。本試驗中IBA濃度為0.5 mg/L時吊瓜根的長勢快,根直徑適中,側根數目多,且幼苗長勢相較于其他培養基植株快。而去除繼代培養這一環節,直接利用腋芽誘導莖蔓后進行生根誘導,大大提高了成苗率。
本試驗煉苗移栽方式可使吊瓜組培苗成活率達90%以上。隨著吊瓜市場的興起,高品質的吊瓜苗供不應求。本試驗極大地克服了利用莖尖培養脫毒苗出苗率低的技術限制,并且利用初代脫毒苗進行誘導,大大降低吊瓜病毒感染率,使組培苗的果實品質得到保障,為建立品質優良的吊瓜組培苗繁育體系奠定了基礎。