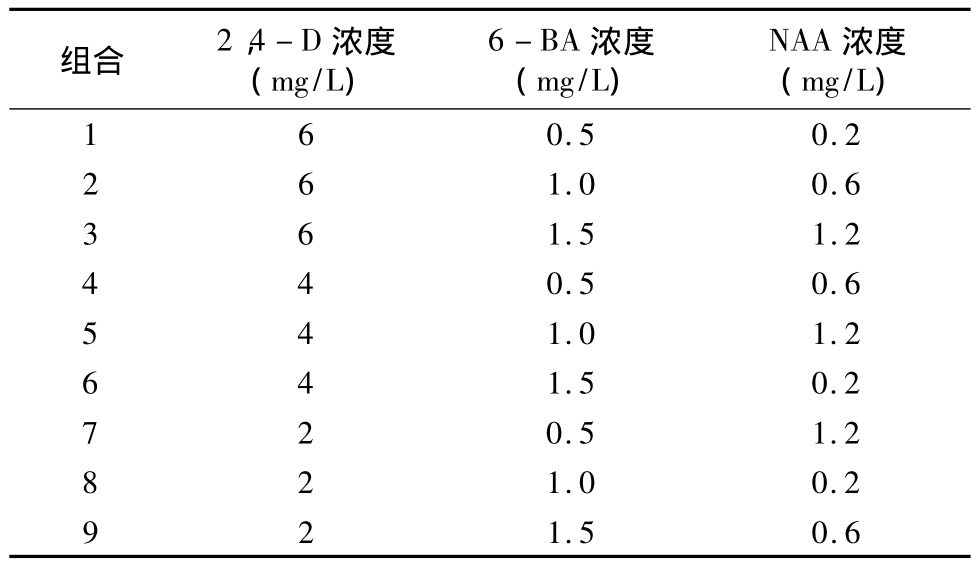
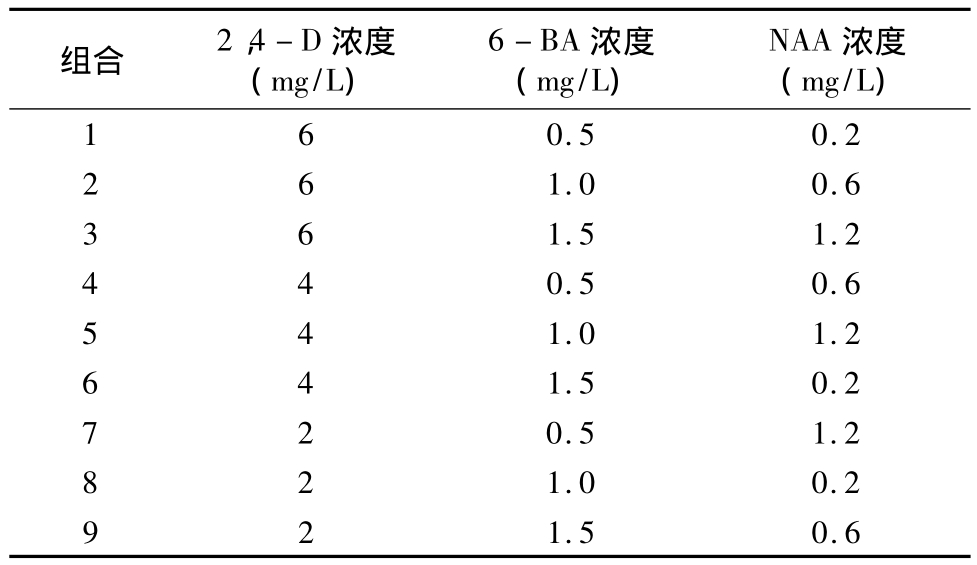
柳枝稷為多年生草本C4植物,在北美洲廣泛種植。柳枝稷植株高大,具有根系發達、防風固沙能力強、耐瘠薄等優點,是沙漠綠化的理想植物。柳枝稷可合成燃料乙醇、甲醇、沼氣、氫氣等,由于其能源產出率高,在乙醇生產過程中易降解,被美國政府確定為替代玉米生產燃料乙醇的首選能源植物。保存并快速繁殖材料是現代生物育種技術的重要研究內容...
上一個:恒溫恒濕空調機組配置
下一個:空氣鳳梨組培快繁技術優化
柳枝稷為多年生草本C4植物,在北美洲廣泛種植。柳枝稷植株高大,具有根系發達、防風固沙能力強、耐瘠薄等優點,是沙漠綠化的理想植物。柳枝稷可合成燃料乙醇、甲醇、沼氣、氫氣等,由于其能源產出率高,在乙醇生產過程中易降解,被美國政府確定為替代玉米生產燃料乙醇的首選能源植物。保存并快速繁殖材料是現代生物育種技術的重要研究內容。研究發現,柳枝稷是一種異型雜交的多倍體單子葉植物,具有高度的自交不親和性。因此,通過遺傳轉化獲得具有高遺傳力的柳枝稷轉基因品種變得尤為重要,轉基因育種的前提是建立的植物組織培養體系。現有的柳枝稷組培研究中,外植體多為葉片、莖尖、節間及幼穗,以這些材料作為外植體,愈傷誘導率普遍較低,且容易受生長周期及季節限制。本研究以柳枝稷成熟種子為材料,探索愈傷誘導過程中很好外源激素配比,從而建立柳枝稷種子組培快繁體系,旨在為開發利用柳枝稷資源提供依據。
1 材料與方法
1.1 材料
柳枝稷品種為Alamo(北京市農林科學院),用自來水沖洗脫殼后的成熟種子,去掉雜質,用無菌水浸泡12 h,沖洗后風干,置于4℃冰箱中備用。
1.2 方法
1.2.1 培養基配制 愈傷組織誘導及分化以MS為基礎培養基,采用3因素3水平進行試驗(表1),pH值為8.0。生根培養基為 1/2MS+NAA(0.4、0.8、1.2、1.6 mg/L)+3% 蔗糖+0.75% 瓊脂,pH值為8.0。配制完成后,121℃高壓滅菌15 min,待溫度冷卻至50~60℃時搖勻,倒入培養皿中,置于超凈臺風干備用。
1.2.2 種子處理 挑選干燥飽滿的種子,首先用6%NaClO溶液消毒2.5 h,輕輕攪動使NaClO與種子充分接觸,然后用無菌水清洗3~5遍,浸泡12 h。之后用6%NaClO溶液消毒20 min,用無菌水清洗種子3~5遍。在無菌條件下,將處理好的種子接種到愈傷誘導培養基中進行培養。
1.2.3 培養條件 選擇同一批成熟種子作為外植體進行愈傷組織誘導及分化試驗,每處理重復5次,每個培養皿中接種30粒種子,置于光照培養箱中培養。培養30~45 d后,選擇株高為2~4 cm的再生苗,切下幼苗轉入生根培養基中,繼續置于光照培養箱中培養,每個組培瓶接種12個外植體,每濃度重復4次,培養10~15 d。愈傷組織誘導培養基試驗因素及水平見表1。GZX-300BS-4光照培養箱(上海新苗醫療器械制造有限公司)培養溫度設置為24℃,光照培養時間為16 h/d,光照強度為12000 lx。
1.2.4 生長指標測定 接種后,每3 d統計1次胚芽數目、胚根出現時間及數目、愈傷組織出現時間及數目等指標。培養30~45 d后,統計種子發芽率及愈傷誘導率,確定很好愈傷組織誘導培養基激素配比。在誘導培養基上培養一段時間后觀察愈傷組織的生長情況,觀察并統計分化出的不定芽生長情況及數目。愈傷誘導分化培養完成后,接種到生根培養基中繼續培養10~15 d,觀察不同濃度NAA對再生苗生根的影響,記錄生根外植體及根的數目。
表1 愈傷組織誘導培養基試驗因素及水平
2 結果與分析
2.1 不同激素配比對種子萌發時間及萌發率的影響
由表2可知,培養5~7 d后,大多數種子都能在愈傷組織誘導培養基上萌發,且不同濃度激素對柳枝稷種子的萌發時間及萌發率均有顯著影響。當2,4-D濃度為6 mg/L、6-BA 濃度為1.0 mg/L、NAA 濃度為0.6 mg/L 時,種子接種后3 d即開始萌發,萌發率達82%。當2,4-D濃度為6 mg/L、6 -BA 濃度為1.5 mg/L、NAA 濃度為 1.2 mg/L 時,種子萌發時間延遲,接種后7 d才開始萌發,且萌發率僅為35%。由此可知,柳枝稷種子萌發的很好培養基為MS+2,4 - D 6 mg/L+6 - BA 1.0 mg/L+NAA 0.6 mg/L。
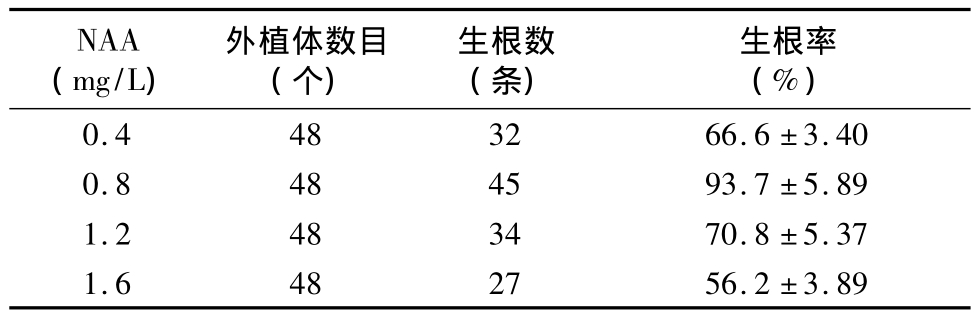
表2 不同濃度激素配比對芽形成及愈傷組織誘導的影響
注:“+++”表示愈傷組織長勢很好,形成的愈傷組織數目、大小均比較理想;“++”表示長勢良好;“+”表示長勢一般,形成的愈傷組織數目較少,體積較小。
2.2 不同激素配比對愈傷組織誘導及分化培養的影響
經消毒處理的成熟種子培養5 d后,部分培養基上開始有愈傷組織形成,隨后逐漸變大,并且隨著愈傷組織的增大其表面逐漸變得干燥,質地緊密結實,顏色多為黃色、嫩綠色(圖1-a)。當 2,4-D濃度為2 mg/L、6-BA濃度為0.5 mg/L、NAA 濃度為1.2 mg/L時,形成愈傷組織所需的時間很長,即培養12 d后才能觀察到愈傷組織的形成。不同激素配比下,外植體愈傷組織的長勢也有顯著差別(圖1-b)。在愈傷誘導培養基上培養25 d后,不同激素配比處理下愈傷組織在色澤、大小等指標方面差異較大,愈傷誘導率很高可達82%,很低僅為35%(表2)。一部分愈傷組織色澤淡黃,體積較小且表面干燥疏松;另一部分愈傷組織色澤嫩綠,體積較大且表面緊實,具有較強的再分化能力,可用于誘導成苗。這些生長狀態良好的愈傷組織培養一段時間后體積逐漸增大,且伴隨出現一些白色顆粒狀胚狀體。繼續培養10 d后,有些原本白色的胚狀體凸起,分化為嫩綠色的幼芽(圖1-c)。隨著培養時間的延長,新形成的幼芽逐漸變綠,并且直立生長,有的幼芽長勢較快,接種到培養基上15 d后可長至2~3 cm。體積較小的愈傷組織接種一段時間后,分化出一些零星的幼芽,隨后幼芽停止生長。將切割后的分化組織接種到新培養基上培養20 d,有的芽能長出長約4~6 cm的新葉,并從嫩綠色變成翠綠色(圖1-d)。愈傷組織誘導及分化的很好培養基為 MS+6 mg/L 2,4-D+1 mg/L 6-BA+0.6 mg/L NAA+3% 蔗糖 +0.75% 瓊脂,pH值為8.0。
2.3 不同濃度NAA對不定芽生根的影響
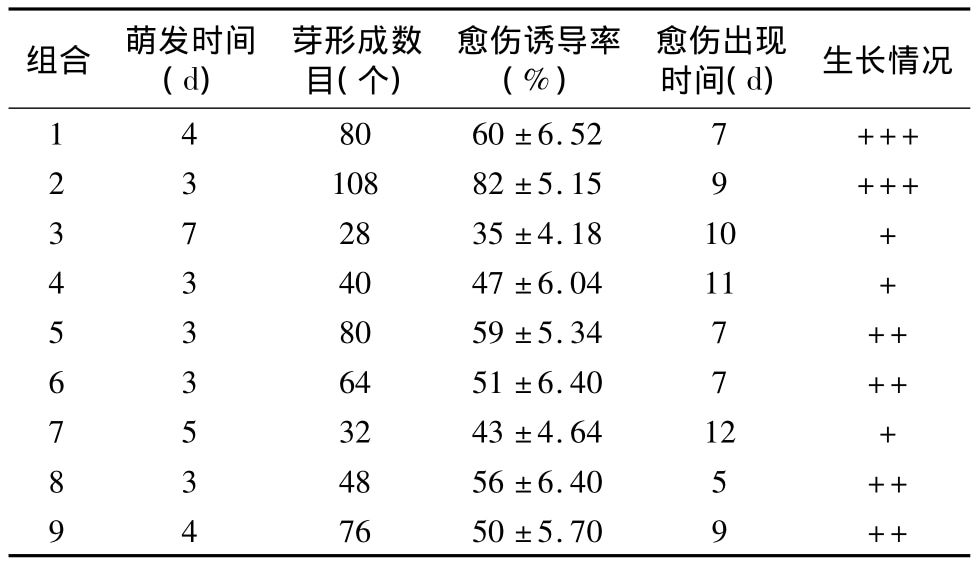
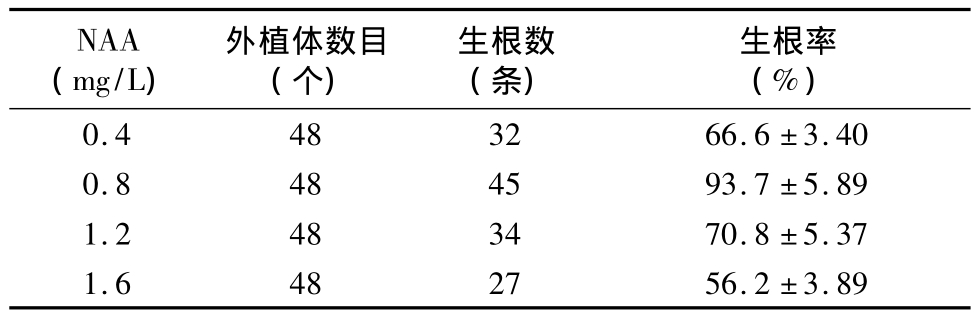
在愈傷組織誘導及分化的很好培養基上培養40 d后,愈傷組織開始分化出大小不一的不定芽。選擇長勢較一致的不定芽切割后接種到含有不同濃度NAA的生根培養基上進行生根誘導(圖1-e)。結果表明,當 NAA濃度為 0.8 mg/L時,生根時間很短,7 d后即可觀察到白色凸起并逐漸形成新根,生根率可達90%以上(表3),每棵再生苗均能誘導出15~20條新生根(圖1-f)。當NAA濃度過低(0.4 mg/L)或者過高(1.6 mg/L)時,新根都會延遲出現。在生根的同時,新生苗新葉長勢良好(圖1-g),平均長約10 cm,部分甚至高達20 cm(圖1-g)。
表3 不同濃度NAA對不定芽生根率及生根數目的影響
2.4 煉苗
當大部分新生苗長出數量不一的新根后,將組培瓶上的封口膜去掉,繼續在培養箱中培養2~3 d,隨后將培養基取出置于室溫下培養,并在培養基表面加入少許無菌水,繼續培養3 d后,將新苗從培養基中輕輕取出,避免損傷根部。用無菌水將幼苗表面的培養基沖洗干凈,移栽至花盆中繼續培養,用塑料薄膜覆蓋以防止水分大量流失。每天用無菌水澆灑新苗,待新苗長勢穩定后,將花盆搬至室外繼續培養煉苗(圖1-h)。當培養條件適合時,大部分幼苗都能正常存活,并且穩定生長(圖1-i)。
3 結論
研究發現,2,4-D、TDZ結合使用對柳枝稷愈傷組織的形成起促進作用。認為,添加不同濃度的2,4-D及6-BA對柳枝稷的愈傷誘導、分化再生有明顯影響。傳統的柳枝稷組培步驟較繁瑣,包括愈傷誘導、繼代、分化及生根等環節,耗時較長,且產率較低。利用柳枝稷成熟種子作為外植體進行愈傷組織的誘導及分化,研究滅菌處理及不同濃度激素組合對愈傷組織誘導及分化的影響,包括愈傷組織誘導、分化、生根等環節,耗時較長。在愈傷誘導過程中,添加一定濃度的6-BA可改變愈傷組織的質量,提高植物分化再生頻率。有研究表明,2,4-D對愈傷組織形成有比較明顯的促進作用,很少被植物細胞所代謝,且不同濃度的2,4-D與其他一些細胞分裂素結合,可以建立組培體系。NAA是廣譜型植物生長調節劑,能促進細胞分裂和擴大,誘導分化組織形成不定根。本研究表明,不同濃度配比的激素愈傷誘導率差異較大,以MS培養基為基本培養基,添加 6 mg/L 2,4-D、1 mg/L 6-BA、0.6 mg/L NAA進行愈傷組織誘導,愈傷誘導率可高達82%。愈傷組織誘導增殖后,在很好激素配比培養基上可直接進行分化培養,能進一步分化出大量新生芽。本方法有效縮短了再生時間,節約了試驗成本,提高了效率。室內煉苗7 d后,將柳枝稷新生苗移至室外培養,可正常存活